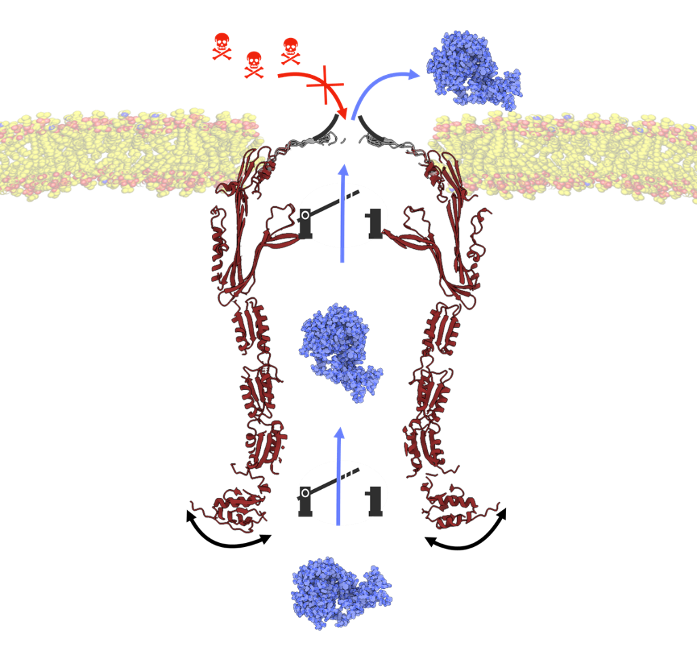
Les bactéries ont développé d’ingénieux canaux membranaires, appelés sécrétines, spécifiquement adaptés à la sécrétion ou à l’assemblage de volumineuses macromolécules extracellulaires. L’organisation structurale des sécrétines est restée inconnue pendant plusieurs décennies, jusqu’à ce que les récents progrès de la cryo-microscopie électronique lèvent enfin le voile sur une organisation structurale atypique en double tonneau-beta géant cloisonné par plusieurs constrictions (voir revue Barbat et al., Biochimie 2023). Ces précieuses informations statiques ne renseignent cependant pas sur la dynamique et le mode d’action de ces pores géants enchâssés dans l’enveloppe bactérienne.
Forts de leurs 20 ans d’expérience sur la manipulation des nanomachines membranaires de la bactérie pathogène Pseudomonas aeruginosa, les chercheurs ont mis en œuvre et mené avec succès une série d’expériences fonctionnelles in vivo sur la sécrétine XcpD du système de sécrétion de type 2 de ce pathogène.
Ils ont ainsi non seulement validé plusieurs interfaces d’interaction à l’intérieur de la sécrétine mais également révélé de fins mécanismes de cloisonnement moléculaire transitoires à différents niveaux du canal, permettant à la bactérie de concilier imperméabilité de l’enveloppe bactérienne et nécessité de sécréter de larges effecteurs.